Производство аммиака До конца прошлого века аммиак производился в промышленных масштабах исключительно как побочный продукт гранулирования угля. Каменный уголь.
Синтез аммиака
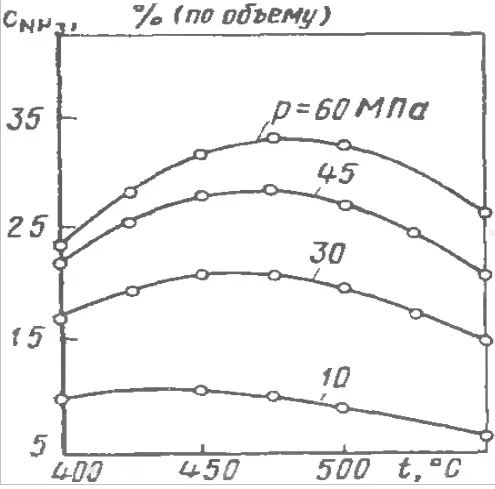
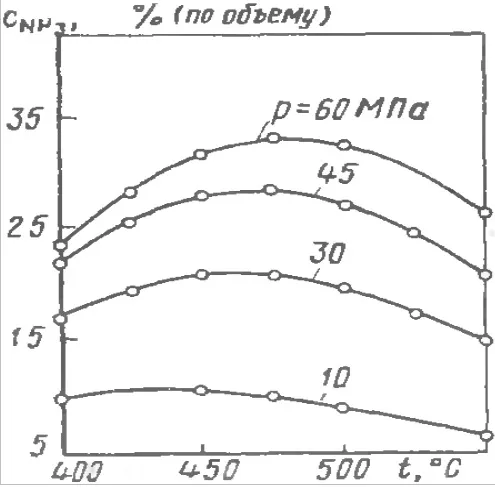
Синтез аммиака — это взаимодействие азота с водородом в жестких условиях, так как реакция обратима, весь процесс происходит при нагревании до 500°, свыше дает отрицательный вариант с меньшим выходом аммиака, также одним из условий синтеза является повышенное давление, которое хорошо влияет на выход NH3.
NH3получение в лаборатории
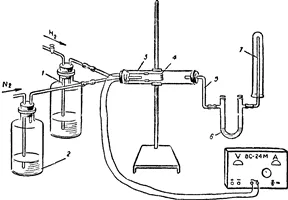
Для эксперимента собирается устройство, как показано на рис.
Аппарат проверяется на герметичность. Вводят поток азота и водорода, следя за тем, чтобы количество пузырьков этих газов, проходящих через колбы 1 и 2, содержащие концентрированную серную кислоту, составляло 1:3. Расход азота и водорода регулируется кранами или зажимами от газового счетчика и опрокидывающего устройства.
Убедитесь, что воздух полностью вытеснен из аппарата (путем поджигания газа, собранного в пробирке 7, в пробирке) и что исходная азотно-водородная смесь не содержит аммиака (лак или фенолфталеин). Включите электрический ток и убедитесь, что в трубке реактора 3 жарко нагревается катушка 4 с катализатором.
Рисунок Установка для синтеза аммиака:
1, 2 — промывочная колба, 3 — трубка реактора, 4 — электрическая катушка, 5, 7 — газовые маятниковые трубки, 6 — дуговая трубка.
Азотно-водородная смесь, которая проходит через спираль катализатора без нагрева, образует даже следы аммиака. При нагревании катализатора образуется аммиак.
После окрашивания дуговой трубки 6 фенолфталеином ее дезактивируют и к отверстию газоотводной трубки 5 подводят стеклянную палочку, смоченную концентрированной соляной кислотой (или жидкой красной лакмусовой бумагой). Для завершения эксперимента отключают ток, выключают кран наклонного аппарата и продолжают подавать азот в течение некоторого времени, пока водород не будет полностью удален из аппарата, а катализатор не остынет.
Синтез аммиака — это обратимая экзотермическая реакция:
Для инициирования реакции требуется нагрев, который осуществляется путем нагревания электроспрея до красного цвета (около 400 °C). (При слишком сильном нагревании аммиак не образуется.) Обнаружение аммиака подтверждается следующими реакциями: (a) в растворе с фенолфталеином:
(b) на воздухе (путем образования белого дыма в присутствии концентрированной соляной или азотной кислоты):
Меры предосторожности. Водород должен быть проверен на чистоту.
В той же реакционной пробирке можно провести тест на разложение аммиака и обнаружить образовавшийся водород. Для этого аммиак пропускают над нагретой спиралью катализатора, собирают продукты разложения и проверяют их на воспламеняемость.
Физические свойства аммиака
Это легковоспламеняющийся бесцветный газ. Его масса 17,03; температура кипения 33,4 °C; плотность воздуха 0,597; коэффициент диффузии газа в воздухе 0,198 см 2 /с; теплотворная способност ь-316,5 кДж/моль; растворимость в воде 34,2 % (масс./масс.). Температура плавления. 650 °C; пределы концентрации в воздухе 15-28% (v/v), в кислороде 13,5-79% (v/v); минимальная энергия воспламенения 680 мДж; максимальное давление взрыва 588 кПа; MWSC 16,2% (v/v); теплотворная способность 1777 K; типичная температура плавления 0,23 м/с при 150 °C.
Водный раствор аммиака, невоспламеняющийся; над его поверхностью возможно образование взрывоопасной смеси аммиака и воздуха. Значения пожарного риска приведены в таблице.
Таблица. Показатели пожарной опасности для аммиачной воды
| Концентрации раствора, % (масс.) | Температура самовоспламенения, °С | Температурные пределы распр. пл., °С | |
| нижний | верхний | ||
| 15 27 | >750>750 | 23 -2 | 33 10 |
В открытой таре и при разливе в помещении образование взрывоопасной концентрации практически невозможно.
2.2.1 Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола).

Промышленный состав аммиака основан на прямом взаимодействии простых веществ — азота N2и водорода H2. Азот, используемый в производстве аммиака, получают путем фракционной перегонки жидкого воздуха и водорода путем паровой конверсии угля или природного газа:
Рассмотрим уравнение для взаимодействия азота с водородом:
Эта реакция является каталитической, т.е. ее скорость многократно возрастает в присутствии катализатора. Пористый катализатор на основе железа используется в качестве катализатора для синтеза аммиака из азотно-водородной смеси.
Поскольку реакция взаимодействия между азотом и водородом является экзотермической, желательно проводить процесс при низких температурах, чтобы сместить равновесие в сторону образования аммиака. Однако без нагревания скорость реакции взаимодействия азота с водородом ничтожно мала, поэтому при выборе температурных условий для синтеза аммиака необходимо ориентироваться на «золотую середину». Эта «золотая середина» — температура около 400-500 о С.
Негативным последствием использования высоких температур является то, что равновесие реакции сильно смещается в сторону противоположной реакции — разложения аммиака, что приводит к снижению выхода.
Согласно уравнению взаимодействия азота и водорода, общее количество газообразных веществ в ходе реакции уменьшается, так как при взаимодействии 3 моль водорода и 1 моль азота (всего 4 моль) образуется только 2 моль аммиака. Исходя из принципа Ле Шателье, негативные последствия разложения аммиака можно уменьшить, если проводить процесс под высоким давлением. Давление азотно-водородной смеси в колонне синтеза создается турбокомпрессором и составляет около 300 атм. Однако даже при таком огромном давлении эффективность преобразования азотно-водородной смеси «за один раз» не превышает 20 %. Дальнейшее повышение давления по разным причинам невозможно, поэтому проблема низкой производительности решается довольно простым способом. Полученный аммиак отделяется от непрореагировавшей азотно-водородной смеси в сепараторе, а оставшаяся смесь подается обратно в башню синтеза с помощью рециркуляционного компрессора вместе с новым питанием. Это называется принципом циркуляции. Принцип циркуляции позволяет увеличить степень преобразования азотно-водородной смеси в аммиак до 95 %.
Производство серной кислоты
Сера или сероводород (побочные продукты нефтеперерабатывающих заводов), минерал пирит FeS2и сульфиды некоторых других D-элементов. Никакое другое сырье не используется.
Наиболее важным сырьем для производства серной кислоты в настоящее время являются сероводород и сера, которые в больших количествах образуются как побочные продукты переработки нефти.
Однако в учебных программах по-прежнему предполагается, что серная кислота в основном производится из пирита. Поэтому мы также рассмотрим основные этапы производства серной кислоты из того же сырья.
Первая стадия
В этом процессе предварительно измельченный пирит сжигается в потоке воздуха, обогащенного кислородом. Процесс протекает в соответствии с уравнением:
Обжиг происходит при температуре около 800 °C в печи. Процесс обжига происходит по так называемому методу кипящего слоя, при котором частицы пирита подаются в печь сверху, а воздух — снизу. Это приводит к тому, что частицы обожженного пирита плавают в потоке воздуха и напоминают кипящую жидкость.
После сжигания пирита образующийся печной газ, содержащий диоксид серы, отделяется от твердых зольных примесей (Fe2O3) с помощью циклона. Циклон — это устройство, в котором печные газы очищаются от более крупных твердых частиц под действием центробежной силы. После грубой очистки газовая смесь дополнительно очищается электростатическим фильтром для удаления оставшихся мелких твердых частиц. Принцип работы электрофильтра основан на том, что пыль прилипает к наэлектризованным металлическим пластинам, которые, после накопления пыли, под действием собственного веса сбрасываются в контейнер для сбора.
После вымывания твердых частиц из печи газ направляется в нижнюю часть так называемой сушильной башни, в верхней части которой в газ вводится концентрированная серная кислота. В данном случае сталкиваются два потока: газовая смесь, поступающая снизу, и поток жидкой концентрированной серной кислоты, поступающий сверху. Очевидно, что таким образом достигается максимальное «перемешивание» газа и осушающей жидкости. Этот метод называется принципом противотока.
Вторая стадия
После очистки от твердых примесей и сушки концентрированной серной кислотой газы поступают в контактное устройство. В контактном устройстве имеются полки с катализатором V2O5который катализирует взаимодействие диоксида серы с кислородом в соответствии с уравнением:
Подобно описанной выше реакции взаимодействия азота с водородом, эта реакция также является каталитической, экзотермической и протекает путем восстановления газов. С точки зрения принципа Ле Шателье, это должно происходить при низких температурах. Однако при низких температурах скорость реакции крайне низка и протекает при оптимальной температуре около 400-500 оС. Смещение реакционного равновесия в сторону разложения SO3при более высоких температурах можно почти полностью избежать, проводя реакцию при более высоком давлении.
Производство метанола
Производство метанола основано на реакции между монооксидом углерода CO и водородом H2которое происходит в соответствии с уравнением:
Технологическая цепочка производства метанола практически идентична технологической цепочке производства аммиака. Это объясняется определенным сходством реакций. Например, реакции образования аммиака и метанола являются экзотермическими, обратимыми, каталитическими и сопровождаются уменьшением объема газа.
При синтезе метанола из окиси углерода и водорода используются те же методы, что и при синтезе аммиака из азотно-водородной смеси:
- наличие катализатора в колонне синтеза;
- принцип теплообмена;
- использование высокого давления для повышения выхода продукта;
- использование высокой температуры для увеличения скорости реакции;
- принцип циркуляции.